プレスリリース
2021(令和3)年 9月 8日
国立大学法人岡山大学
https://www.okayama-u.ac.jp/
[画像1: https://prtimes.jp/i/72793/249/resize/d72793-249-6ca729fc3e3fb521f29b-0.jpg ]
<発表のポイント>
これまでタンパク質の変性について「タンパク質は、それを構成する疎水基が水との接触を避ける様に立体構造を安定化する」と説明されてきました。
長年信じられてきたこの「疎水性相互作用仮説」を、独自に開発した理論計算により検証しました。
その結果、疎水基の水との接触はむしろタンパク質を不安定化(変性)させており、天然構造の安定性はタンパク質分子内に働く“直接相互作用”によることが明らかとなりました。
◆概 要
国立大学法人岡山大学(本部:岡山市北区、学長:槇野博史)の異分野基礎科学研究所(RIIS)の墨智成准教授と立命館大学生命科学部応用化学科の今村比呂志助教は、独自に開発した理論計算を駆使して、これまで広く信じられてきたタンパク質の変性のメカニズム「疎水性相互作用仮説」の問題点を明らかにすると共に、その代替となる安定化メカニズムを提案しました。
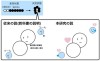
タンパク質は体内で働く不可欠な分子であるという他に、近年は酵素やバイオ医薬品(例えば抗がん剤や新型コロナウイルスの治療薬など)として応用されています。タンパク質が働くためには規則正しい立体構造(天然構造)が保たれている必要がありますが、この天然構造はそれほど安定ではなく、しばしば崩れ機能が失われます。これを変性といいます。タンパク質がどのようなメカニズムで変性するのか?これはタンパク質分子を応用する上でも重要な課題となってきました。現在の教科書には「タンパク質の天然構造は、それを構成する疎水基が水との接触を避ける様に、いわゆる“疎水効果”によって安定化する」と説明があります。
今回の研究ではこの仮説を理論的に検証すべく、液体の密度汎関数理論を適用して、水を介した間接的相互作用の寄与を計算しました。その結果、水は疎水基を露出させるように、すなわち天然構造をむしろ不安定化していることがわかりました。さらに、天然構造の安定性はタンパク質分子内に働く直接相互作用に起因することを明らかにしました。
この研究成果は2021年8月12日、タンパク質科学会誌「Protein Science」に掲載されました。
[画像2: https://prtimes.jp/i/72793/249/resize/d72793-249-14470fb255dffda20348-1.jpg ]
◆研究者からのひとこと
教科書を書き換える程の成果であり、結果には当初大変驚きました。この新しい学説が広まるまで少し時間がかかるかもしれませんが、基礎科学として重要な一歩です。
抗体タンパク質をはじめとするバイオ医薬品は立体構造が不安定であると効果の低下や保存が難しくなるため、タンパク質を安定化させることは応用面でも非常に重要です。従来はタンパク質を安定化すると思われていた水の効果を見直すことは、タンパク質の改良技術の向上につながると考えています。
[画像3: https://prtimes.jp/i/72793/249/resize/d72793-249-c814e547d8a959c76721-2.jpg ]
◆論文情報
論 文 名:Water-Mediated Interactions Destabilize Proteins
掲 載 紙:Protein Science
著 者:Tomonari Sumi, Hiroshi Imamura
D O I:10.1002/pro.4168
U R L: https://doi.org/10.1002/pro.4168
◆詳しいプレスリリースについて
水はタンパク質の立体構造を不安定化する 〜長年信じられてきたタンパク質変性メカニズムの見直しへ〜
https://www.okayama-u.ac.jp/up_load_files/press_r3/press20210903-2.pdf
◆参 考
・二足歩行する“細胞内の運び屋” モータータンパク質「キネシン」の設計原理を解明
https://www.okayama-u.ac.jp/tp/release/release_id461.html
・60年間支持されてきたタンパク質構造安定性理論の検証への挑戦 〜タンパク質折り畳みの駆動力がタンパク質内直接相互作用に起因することを示唆〜
https://www.okayama-u.ac.jp/tp/release/release_id609.html
・モータータンパク質「F1回転分子モーター」のエネルギー変換効率を実証これまでの定説より有意に下回ることが判明
http://www.okayama-u.ac.jp/tp/release/release_id628.html
・治療薬を包含した高分子ミセルの相互作用場を解明!優れた薬物送達のメカニズム理解への新手法
https://www.okayama-u.ac.jp/tp/release/release_id818.html
・なぜ私たちの脳は学習や記憶をすることができるのか〜海馬興奮性シナプスにおける長期増強/長期抑制発現機構の統一的理解〜
http://www.okayama-u.ac.jp/tp/release/release_id758.html
・アザラシの海洋適応に伴うタンパク質進化のしくみを解明
https://prtimes.jp/main/html/rd/p/000000233.000072793.html
◆参考情報
・岡山大学異分野基礎科学研究所(RIIS)
http://www.riis.okayama-u.ac.jp/
・【岡山大学】岡山大学異分野基礎科学研究所竣工式を挙行しました
https://prtimes.jp/main/html/rd/p/000000089.000072793.html
[画像4: https://prtimes.jp/i/72793/249/resize/d72793-249-b4d2a6d7c2ba0c79944f-3.jpg ]
◆本件お問い合わせ先
岡山大学異分野基礎科学研究所 准教授 墨 智成
〒700-8530 岡山県岡山市北区津島中3-1-1 岡山大学津島キャンパス
TEL: 086-251-7837
http://www.cc.okayama-u.ac.jp/~sumi/index.html
<岡山大学の産学連携などに関するお問い合わせ先>
岡山大学研究推進機構 産学連携・知的財産本部
〒700-8530 岡山県岡山市北区津島中1-1-1 岡山大学津島キャンパス 本部棟1階
TEL:086-251-8463
E-mail:sangaku◎okayama-u.ac.jp
※ ◎を@に置き換えて下さい
https://www.orsd.okayama-u.ac.jp/
岡山大学メディア「OTD」(アプリ):https://prtimes.jp/main/html/rd/p/000000011.000072793.html
岡山大学メディア「OTD」(ウェブ):https://prtimes.jp/main/html/rd/p/000000215.000072793.html
岡山大学SDGsホームページ:https://sdgs.okayama-u.ac.jp/
岡山大学Image Movie (2020):https://youtu.be/pKMHm4XJLtw
産学共創活動「岡山大学オープンイノベーションチャレンジ」2021年9月期共創活動パートナー募集中:
https://prtimes.jp/main/html/rd/p/000000237.000072793.html
岡山大学『企業の人事担当者から見た大学イメージ調査2022年度版』中国・四国1位!!
https://prtimes.jp/main/html/rd/p/000000122.000072793.html
岡山大学「THEインパクトランキング2021」総合ランキング 世界トップ200位以内、国内同列1位!!
https://prtimes.jp/main/html/rd/p/000000070.000072793.html
[画像5: https://prtimes.jp/i/72793/249/resize/d72793-249-da98e0cc0c62c1592aa0-4.jpg ]
プレスリリース提供:PR TIMES