プレスリリース
東京医科大学(学長:宮澤啓介/東京都新宿区)医学総合研究所未来医療研究センター実験病理学部門の角南義孝講師(特任)と中村卓郎特任教授らが、急性骨髄性白血病(AML)の原因遺伝子TRIB1 によるがん抑制遺伝子C/EBPαを分解する仕組みを、ノックアウトマウスを用いた詳細な解析により明らかにしました。
この研究成果は、2024年10月4日、Leukemia誌に掲載されました。
【概要】
東京医科大学(学長:宮澤啓介/東京都新宿区)医学総合研究所未来医療研究センター実験病理学部門の角南義孝講師(特任)と中村卓郎特任教授らが、急性骨髄性白血病(AML)の原因遺伝子TRIB1 によるがん抑制遺伝子C/EBPαを分解する仕組みを、ノックアウトマウスを用いた詳細な解析により明らかにしました。
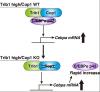
TRIB1は偽キナーゼ蛋白質 * をコードし、パートナーであるE3ユビキチンリガーゼ * のCOP1とともにC/EBPα蛋白質 * を分解することが従来の研究で知られていました。研究チームは、今回の研究で新たに作製したCOP1ノックアウト(KO)マウスを使って、TRIB1を発現するAML細胞でCOP1をKOするとC/EBPα蛋白質の急速な増加が生じてAML細胞の増殖停止と分化が誘導されて、マウスに移植した白血病の発症が顕著に抑えられることを見出しました。C/EBPα蛋白質の急速な増加はC/EBPA遺伝子のmRNAの高い発現を背景としていて、TRIB1とCOP1による蛋白質レベルでの制御から来るフィードバック機構に基づくものであることがわかりました。今回の研究で、ヒトのAMLでTRIB1とC/EBPA遺伝子がともに高発現する症例は、COP1抑制に対する脆弱性が生じることから、TRIB1/COP1を標的とする治療法が有望であることが明らかになり、今後の研究開発に弾みがつくものと期待されます。
この研究成果は、2024年10月4日、Leukemia誌に掲載されました。
【本研究のポイント】
● TRIB1の過剰発現でがん化したマウスAML細胞でCOP1をKOすると急速に増殖が停止し、好中球分化が誘導された。この時C/EBPα蛋白質の迅速な増加が観察されたが、TRIB1を発現しないAML細胞では、COP1をKOしてもC/EBPα蛋白質は増加せず増殖停止も認められなかった。
● 元々TRIB1を発現しないAML細胞でも、後からTRIB1を導入するとCOP1 KOにより増殖停止とC/EBPα蛋白質の増加が生じた。
● C/EBPα蛋白質の迅速な増加はCEBPA遺伝子のmRNA発現亢進に基づき、TRIB1によるC/EBPα蛋白質レベルの低下によるフィードバック機構が原因と考えられた。
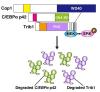
● TRIB1蛋白質はC/EBPα蛋白質の分解を誘導するだけではなく、自身もCOP1によって分解されていた。
● ヒトAMLの中でTRIB1とCEBPAのmRNA高発現が相関する細胞株では、COP1 KOによってマウスAMLと同様の増殖抑制効果が示された。
● NPM1変異 * を有するAML症例にはTRIB1とCEBPAのmRNA高発現グループが存在し、今後TRIB1/COP1経路を標的とした治療法の対象として有望視される。
【研究の背景】
ゲノム解析技術の進歩により、白血病を含むがんの遺伝子レベルでの異常の多くは同定され意義も解明されてきています。一方、がん遺伝子やがん抑制遺伝子が蛋白質レベルでどのような制御を受けているかは不明な点が多く存在します。C/EBPαはAMLのがん抑制遺伝子として重要性が早くから着目され、遺伝子変異により失活している症例も認められます。しかしながら、大部分のAMLではC/EBPαは遺伝子レベルでは正常であるため、蛋白質レベルでの制御機構の解明が待たれていました。
研究チームは、マウスAMLでHOXA9の協調遺伝子としてTRIB1を同定し、AML発症に重要な機能としてC/EBPαをCOP1にリクルートして分解することと、MEK/ERKの機能亢進であることを明らかにしていました。TRIB1/COP1は生物の進化の過程で古くから保存されているシグナル系ですが、この系をがん細胞がどのように利用しているのか未解明な部分が多く、AMLの治療における有用性も不明でした。
【本研究で得られた結果・知見】
AMLにはTRIB1/COP1に依存して増殖するグループが存在することがわかりました。このような症例群は、TRIB1とCEBPAのmRNA発現の高い特徴があり、TRIB1/COP1系の遮断によりC/EBPα蛋白質の急速な増加がもたらされて白血病細胞は死滅します(図1)。研究チームは現在TRIB1/COP1系を標的とする治療薬の開発を推進していますが、開発が進展したあかつきにはTRIB1/CEBPAをバイオマーカーとするAML症例を選別して有効な治療を確立することが期待できます。特に、正常核型AMLに多いNPM1変異症例の中には対象候補となる症例が集積していることも今回の研究で明らかになりました。
転写レベルでの遺伝子発現と蛋白質量の大きな乖離が観察されたことも、本研究で得られた特筆すべき知見です。mRNAと蛋白質の量は通常正の相関を示していますが、TRIB1関連AMLではC/EBPαのmRNAと蛋白質は逆相関を示すことがわかりました。また、TRIB1蛋白質は遺伝子の活性化が生じても検出が困難で、その原因は不明でした。従来の研究では、TRIB1の役割はC/EBPαをCOP1にリクルートして分解することだけが提唱されていましたが、本研究によりTRIB1自身も大部分がCOP1によるユビキチン化で分解されていることが明らかになりました(図2)。
【今後の研究展開および波及効果】
AMLの治療成績は近年目覚ましく向上していますが、難治性の症例は依然として存在し新しい治療薬の導入が待たれています。HOXA9を発現するAMLは悪性度が高く、この中にはTRIB1が活性化しているグループが存在します。今回の研究は、このようなサブグループの分子病態に脚光を当てるとともに、TRIB1/COP1/C/EBPαの経路の重要性を明らかにしたものです。研究チームが進めているTRIB1/COP1を狙った創薬も、対象となる症例の絞り込みが重要であり、その意味でも今回の研究成果は今後のAMLの治療開発上重要な知見を提示したものと考えられます。TRIBファミリーとCOP1の相互作用はAML以外でも固形がん・代謝異常・免疫異常にも関わっていて、今後これらの疾患の分子病態の解明にも資するものと期待されます。
【用語の解説】
偽キナーゼ蛋白質*1
偽キナーゼ(pseudokinase)蛋白質はキナーゼ蛋白質の骨格を有するにも関わらず、アミノ酸の欠失や変異によりリン酸化を触媒する酵素活性を失った分子で、哺乳動物では60種余りが知られている。個々の偽キナーゼは、活性型キナーゼに結合して干渉作用を示すもの、蛋白質結合におけるアダプターとして機能するもの、RNA修飾を制御するものなど多様な機能を有し、がん・代謝疾患・免疫疾患・神経疾患など多くの疾患に関わっている。
E3ユビキチンリガーゼ*2
ユビキチンプロテアソーム系は蛋白質の分解を促進するが、E3ユビキチンリガーゼは標的とする蛋白質に特異的に結合してユビキチン化を進める。ユビキチン化された蛋白質は26Sプロテアソームに認識され分解される。E3リガーゼは蛋白質の半減期や総量を決定する翻訳後修飾の1つとして生命現象に不可欠な分子であり、600種類以上が知られている。
C/EBPα蛋白質*3
C/EBPαはC/EBPファミリーに所属する転写因子。遺伝子名はCEBPAで、CEBPA mRNAからp42とp30の2つのアイソフォームが翻訳される。この内、p42は骨髄顆粒球の分化を促進し幼若な前駆細胞の増殖を抑えるため、CEBPAはAMLのがん抑制遺伝子として重要である。TRIB1/COP1はp42だけを特異的に分解するためがん化のシグナルを亢進させる。
NPM1変異*4
ヒトAMLは、しばしば染色体の構造異常を伴い融合遺伝子が形成される。融合遺伝子は悪性度を決定する予後因子として重要だが、60%以上は異常を伴わない正常核型AMLである。この内の半数程度、全体の30%はヌクレオフォスミン遺伝子NPM1の変異を有している。NPM1の変異が生じると転写因子HOXA9の発現亢進が生じる。NPM1変異を有するAMLはヘテロな集団で他の遺伝子変異との組み合わせにより予後不良になることも少なくないので、より詳細な層別化が必要である。
【論文情報】
タイトル:Rapid increase of C/EBPα p42 induces growth arrest of acute myeloid leukemia (AML) cells by Cop1 deletion in Trib1-expressing AML
著 者:角南義孝、芳野聖子、山崎ゆかり、岩元貴、中村卓郎*(*:責任著者)
掲載誌名:Leukemia
DOI : https://doi.org/10.1038/s41375-024-02430-4
【主な競争的研究資金】
文部科学省 科学研究費 基盤研究(A) 19H01035 (中村卓郎)、基盤研究(C) 22K08492 (角南義孝)、学術研究支援基盤形成 22H04922(先端モデル動物支援事業、AdAMS)
【医学総合研究所 未来医療研究センター 実験病理学部門ホームページ】
https://tmu-ims.com/sosiki/miraiiryou/
▼本件に関する問い合わせ先
企画部 広報・社会連携推進室
住所:〒160-8402 東京都新宿区新宿6-1-1
TEL:03-3351-6141(代)
メール:d-koho@tokyo-med.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/