プレスリリース
近畿大学生物理工学部(和歌山県紀の川市)教授 山縣一夫、同大学院生物理工学研究科 博士後期課程1年 米澤直央、慶應義塾大学医学部(東京都新宿区)電子顕微鏡研究室技術員 信藤知子、東京工業大学科学技術創成研究院(神奈川県横浜市)博士研究員 小田春佳(研究当時)、同教授 木村宏、大阪大学大学院生命機能研究科(大阪府吹田市)招へい教授 平岡泰、同特任教授 原口徳子の研究グループは、精子の代わりに精製したDNA溶液を生きたマウス卵子に注入することにより、人工細胞核を構築することに世界で初めて成功しました。
これまで、マウス卵子内において人工細胞核の部分的構造の再構築は可能だったものの、機能を正確には再現できていませんでした。本研究では、細胞の核として機能させるために必要な条件も見出しました。本研究成果は、細胞核の機能獲得に必要なメカニズムを明らかにするとともに、絶滅動物の復活や人工的な生命の創生などにつながることが期待されます。
本件に関する論文が、令和6年(2024年)8月14日(水)に、国際的な科学雑誌"Genes to Cells(ジーンズ トゥー セルズ)"に掲載されました。
【本件のポイント】
●精製したDNA溶液を生きたマウス卵子に注入することにより、人工的な細胞核をつくりだすことに世界で初めて成功
●作製した人工細胞核は、本物の核に非常に似た構造を形成しており、核と細胞質間の物質輸送能力を持つ
●本研究成果は、今後絶滅動物の復活や人工的な生命の創生などにつながると期待される
【研究の背景】
細胞内にある核は、遺伝情報であるゲノムDNAが入っており、DNA複製や転写などほぼ全ての生命現象に関わる重要な細胞小器官です。しかし、核の構造と機能が構築されていく過程や、核が形成されるために必要な要因などについてはあまり研究が進んでおらず、未だに不明な点が多いのが現状です。
これまでの細胞の核形成に関する先行研究の多くは、カエルの卵母細胞の抽出物を用いており、細胞が生きたままの状態で核を観察することができませんでした。そこで、研究グループは、先行研究においてDNAビーズ※1 をマウスの受精卵の細胞内に導入し、ライブセルイメージング※2 により細胞を生きたまま観察することで、核の構築メカニズムの解明に取り組んできました。その結果、DNAが特定の構造をとり、核として必要な核膜や核膜孔複合体※3 を形成する様子を人工的に再現することに成功しました。しかし、マウス受精卵内で構築した核に似た構造体は、核に本来ある核と細胞質の間の物質輸送能力を持っておらず、核の機能を完全に獲得した構造の構築は達成できていませんでした。
【本件の内容】
研究グループは、哺乳類の卵子内で人工的に細胞核をつくりだすことで、核構築のメカニズムや、核を形成するための必要最低条件を調べることをめざし、研究に取り組みました。
先行研究の結果をふまえ、卵子に導入するDNAの種類や長さ・濃度、導入方法、注入時期を詳細に検討することで、物質輸送能力を持つ人工細胞核が再構築されるかを評価しました。
その結果、精製したDNA溶液を精子の代わりに注入することで受精のような過程が進行し、本物の核に非常に似た構造を構築できることがわかりました。また、DNAの長さや濃度により、注入したDNAの挙動が異なることもわかり、最適なDNAの長さと濃度を明らかにしました。
DNA溶液を注入した胚を観察した結果、注入したDNAがヌクレオソーム構造※4 を形成していること、注入したDNAの周囲に本物の核と似た核膜と核膜孔複合体ができていること、そして、核として必要な物質輸送能力があることなどを確認できました。また、ライブセルイメージングで観察したところ、注入したDNAが核膜孔複合体を獲得する様子を世界で初めて捉えました。
本研究により、核輸送能力がある人工の核をつくりだすことに成功し、今後さらに研究を進めることで完全な人工細胞核を作製できれば、絶滅動物の復活や人工的な生命の創生などにつながることが期待されます。
【論文掲載】
掲載誌:Genes to Cells(インパクトファクター:2.1@2022)
論文名:
Reconstruction of artificial nuclei with nuclear import activity in living mouse oocytes
(生きたマウス卵母細胞における核輸送活性を有する人工細胞核の再構築)
著者 :
米澤直央1、信藤知子2、小田春佳3、木村宏3、平岡泰4、原口徳子4,*、山縣一夫1,* *責任著者
所属 :
1 近畿大学生物理工学部、2 慶應義塾大学医学部電子顕微鏡研究室、3 東京工業大学科学技術創成研究院細胞制御工学研究センター、4 大阪大学大学院生命機能研究科
URL :https://doi.org/10.1111/gtc.13149
DOI :10.1111/gtc.13149
【研究の詳細】
研究グループが先行研究で試みた、マウス受精卵内にDNAビーズを導入する方法で再構築した核様構造は、ヌクレオソーム構造や核膜・核膜孔構造を有しており、また、これまでに核構築に関わるとされるさまざまな分子も通常の核と同様に存在していました。それにも関わらず、核と細胞質間の物質輸送能力を欠いていました。この原因として、特定の分子の欠乏というよりは、DNAの量や長さ、DNAの注入タイミングといった物理化学的因子のミスマッチが考えられました。そこで研究グループは、細かく条件設定がしやすい精製DNA溶液を用いて、検討を行いました。
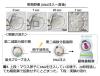
(1)マウス卵子へのDNA注入法の確立
マウス卵子内でDNAから人工細胞核を作製するためには、卵子細胞質中にDNAを注入する必要があります。マウス卵子へのDNA注入法は、マイクロインジェクション技術を用いました(図1)。DNAはDNAビーズとしてではなく、DNA溶液として注入し、核様構造を形成するために必要なDNAの長さ・濃度・時間の条件を検討しました。その結果、少なくとも長さ48.5kbp(キロベースペア)※5 以上で、濃度100ng/Lであれば卵子内で拡散せず、本物の核に酷似した形態を持つ核様構造になることがわかりました。また、注入されたDNAの挙動はDNAの長さや濃度により異なることがわかりました。さらに、天然の核に酷似した核様構造を構築するためには、DNAを注入するタイミングが重要であり、卵子の細胞周期のうち、分裂終期を通過する条件に注入をすればよいことも明らかになりました。
※図1
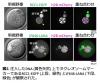
(2)注入したDNA周囲へのヌクレオソーム構造の観察
核輸送を行う核タンパク質のなかに、ヌクレオソームに結合するRCC1があります。つまり、注入したDNAが核輸送能力を獲得するためには、注入DNA上にヒストンタンパク質が集積し、ヌクレオソームの構造を形成する必要があります。免疫染色法※6 により確認した結果、注入したDNA上にヒストンタンパク質の集積を確認しました。次に、ヌクレオソームを形成していることの指標となるタンパク質であるRCC1-EGFPについて、ライブセルイメージングを用いて確認しました。さらに、別のヌクレオソーム結合プローブであるJF646-LANAも用いて確認しました。その結果、注入したDNA上でそれぞれのタンパク質のシグナルを検出することができました(図2)。以上の結果から、マウス卵子内に注入したDNAは、ヌクレオソームを形成していることがわかりました。
※図2
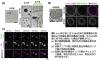
(3)DNA周囲の核膜および核膜孔複合体構造の観察
核輸送は、核膜上に多数点在する核膜孔複合体と呼ばれる穴を通じて行われます。つまり、注入したDNAが核輸送能力を獲得するためには、核膜と核膜孔複合体を形成している必要があります。これらの構造の有無を確かめるために、まずは電子顕微鏡観察を行いました。その結果、注入したDNAの周囲に本物の核と酷似した核膜と核膜孔複合体が観察されました(図3a)。さらに、核膜孔複合体を構成するタンパク質や核膜タンパク質が存在するかを、免疫染色により確かめたところ、注入したDNAを取り囲むように、それらの存在が観察されました(図3b)。また、核膜孔複合体を構成するタンパク質をライブセルイメージングにより観察したところ、DNA注入直後は認められませんでしたが、時間経過とともに観察され、注入したDNAが核膜孔複合体を獲得する様子を世界で初めて捉えました(図3c)。
※図3
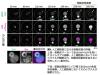
(4)人工細胞核における物質輸送能力の評価
最後に、作製した人工細胞核が核輸送能力を持っているか確認するために、蛍光タンパク質を付加した核局在化シグナル(NLS)※7 が人工細胞核に入るかどうかを観察しました。その結果、蛍光タンパク質が人工細胞核内に流入することが確認されました。この蛍光タンパク質が取り込まれた人工細胞核に対して、核輸送阻害剤であるimportazoleを添加したところ、蛍光タンパク質が流出することが観察されました(図4上段)。さらに、核輸送に関与する因子として知られるRanというタンパク質が人工細胞核に存在していたことから(図4下段)、研究グループは、核輸送能力を有する人工細胞核を構築できたと結論づけました。
※図4
【研究代表者のコメント】
山縣一夫(やまがたかずお)
所属 :近畿大学生物理工学部 遺伝子工学科
近畿大学大学院生物理工学研究科
職位 :教授
学位 :博士(農学)
コメント:本研究では、マウス卵子内に導入するDNAの長さ、濃度、注入タイミングを調整することで、卵子由来の天然の細胞核と酷似した構造を持ち、かつ核輸送能を持つ人工細胞核を再構築することに成功しました。しかしながら、作製した人工細胞核では、転写やDNA複製が行われているかはわかっておらず、ましてや分裂をさせることにも成功していません。完全な細胞核を作製するためには、今後のさらなる検証が必要になりますが、これらの試みを地道に繰り返すことで、細胞核の構築原理の定性的・定量的な解明に結び付くと考えています。また、細胞核の機能を完全に再現できる人工細胞核を作製することができれば、例えば絶滅動物などのゲノムDNAを試験管内で人工的に合成し、近縁種の卵子に注入すれば絶滅動物の復活が望める可能性があります。
【用語解説】
※1 DNAビーズ:DNAを結合させた微小ビーズ。本研究で使用しているDNAビーズは、直径およそ3mの磁気ビーズの周りに、長さ8kbpほどの直鎖化したプラスミドDNAを付着させたもの。
※2 ライブセルイメージング:緑色蛍光タンパク質などを用いて、細胞内におけるタンパク質や構造を生きたまま連続的にタイムラプス観察をする手法。本研究では、ヒストンタンパク質を赤色に染めることで細胞核を可視化している。
※3 核膜孔複合体:核と細胞質との間の物質輸送を媒介する、巨大なタンパク質複合体。
※4 ヌクレオソーム構造:細胞核野中で、DNAはヒストンと呼ばれるタンパク質に巻き付いて存在しており、その構造をヌクレオソームという。ヒストンタンパク質である、4種類のコアヒストン(ヒストンH2A、H2B、H3、H4)から構成される、ヒストン8量体に146bpのDNAが巻き付いている。
※5 kbp(キロベースペア):DNAは、アデニン(A)、シトシン(C)、グアニン(G)、チミン(T)という4つの塩基対(base pair:bp)から構成されており、kbpは、この塩基対がおよそ1,000個つながった長さを示す。
※6 免疫蛍光法:色素のついた抗体を用いて、細胞内における目的のタンパク質の局在を調べる方法。
※7 核局在化シグナル(NLS):タンパク質を細胞質から核内へと移行するために必要なアミノ酸配列。
【関連リンク】
生物理工学部 遺伝子工学科 教授 山縣一夫(ヤマガタカズオ)
https://www.kindai.ac.jp/meikan/1365-yamagata-kazuo.html
生物理工学部
https://www.kindai.ac.jp/bost/
▼本件に関する問い合わせ先
広報室
住所:〒577-8502 大阪府東大阪市小若江3-4-1
TEL:06‐4307‐3007
FAX:06‐6727‐5288
メール:koho@kindai.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/