プレスリリース
―短期・長期にわたってウイルス感染を抑制するサイトカインを発見―
国立成育医療研究センター(所在地:東京都世田谷区大蔵、理事長:五十嵐隆)再生医療研究センターの阿久津英憲、国立感染症研究所インフルエンザ・呼吸器系ウイルス研究センターの宮川敬、同ウイルス第三部の梁明秀らの研究グループは、横浜市立大学、国立国際医療研究センターと共同で、ヒト腸管オルガノイド[1]「ミニ腸[2]」を用いて、新型コロナウイルス(SARS-CoV-2)に関する研究を行いました。
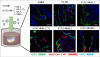
研究では、SARS-CoV-2のデルタ株とオミクロン株系統(BA.2、BA.2.75、BA.5、XBB.1)において、腸での増殖性(ウイルス量がどう変化するか)、細胞傷害性(細胞の生存や機能にどう影響をあたえるか)、持続感染性(どのくらいの期間、感染するか)を検証しました。その結果、BA.2.75の腸管上皮細胞[3]での増殖性は、BA.2より12.5倍も高いことが明らかになりました。一方で、BA.5やXBB.1などは、BA.2と同様に腸での増殖性が低いことが分かりました。(図1)
[画像1]https://digitalpr.jp/simg/1706/85623/600_342_202403271501186603b62ea4106.jpg
【図1 SARS-CoV-2のミニ腸への感染】
また、デルタ株やBA.2.75に感染したミニ腸では、細胞死マーカーの上昇や炎症性サイトカイン[4]の顕著な分泌が見られ、腸の組織での細胞傷害性が示唆されました。一方、抗ウイルス性サイトカインの一種であるインターフェロン[5](IFN)-λ2の分泌は、腸での増殖性が低いBA.2、BA.5、XBB.1では顕著に増加し、腸での増殖性の高いデルタ株やBA.2.75では低い値を示しました。(図2)
[画像2]https://digitalpr.jp/simg/1706/85623/600_197_202403271528096603bc79af4e2.jpg
【図2 感染ミニ腸の分泌サイトカイン解析結果】
そこで、デルタ株やBA.2.75感染時にIFN-λ2を投与すると、これらの短期および長期のウイルス感染が顕著に抑制されました。これらの結果からIFN-λ2は、腸においてSARS-CoV-2の感染から宿主を防御する役割があることが示されました。
さらに、デルタ株とBA.2.75は、ミニ腸において30日を超える長期間にわたって持続的に感染することも明らかになりました。SARS-CoV-2は、気道や肺といった呼吸器以外の臓器にも感染することが知られていますが、腸でのウイルスの持続的な感染がいわゆるコロナ後遺症に関係することが報告されています。本ミニ腸モデルを活用することで、SARS-CoV-2が腸で持続的に感染するメカニズムの解明や、コロナ後遺症の克服に向けた新たな治療法の開発に役立つことが期待されます。
本研究は、デルタ株とオミクロン株系統の腸管組織における増殖性の違いを明らかにするとともに、IFN-λ2がSARS-CoV-2の長期にわたる感染を抑制させることに重要な役割を果たすことを示しました。新型コロナウイルス感染症(COVID-19)の病態理解と新たな治療法の開発につながる重要な知見です。
本研究成果は、2024年3月15日に米国消化器病学会の学会誌「Cellular and Molecular Gastroenterology and Hepatology (CMGH)」にオンライン掲載されました。
【プレスリリースのポイント】
・iPS細胞から創り出した「ミニ腸」にSARS-CoV-2を感染させ、増殖性、細胞傷害性、持続感染性を
検証しました。
・BA.2.75に感染したミニ腸では、炎症性サイトカインが顕著に分泌され、腸における強い細胞傷害
性が示唆されました。
・デルタ株、BA.2.75では、30日を超える長期間にわたって、ミニ腸での持続感染が確認されました。
・インターフェロン(IFN)-λ2を投与すると、短期および長期にわたってデルタ株やBA.2.75の増殖を
抑制させることができました。IFN-λ2は、SARS-CoV-2の腸への感染から宿主を守る役割があると考
えられます。
[画像3]https://digitalpr.jp/simg/1706/85623/600_243_202403271528146603bc7e0e03a.jpg
【図3 SARS-CoV-2持続感染におけるIFN-λ2の効果】
【研究背景】
新型コロナウイルス感染症(COVID-19)は、全世界で約7億人の罹患者と約700万人の死者を出し、原因ウイルスSARS-CoV-2の変異株の度重なる出現によりパンデミックが長期化しました。SARS-CoV-2は気道や肺といった呼吸器以外にもさまざまな臓器に感染し、いわゆるコロナ後遺症を引き起こすことが分かってきています。後遺症の治療には対症療法しかなく、その治療法や予防法の開発は喫緊の課題です。ほとんどの軽症COVID-19患者の呼吸器からは感染後約2週間でウイルスが検出されなくなりますが、一部の患者の便から感染後数ヶ月にわたってウイルスが検出されることが報告され、近年、SARS-CoV-2の持続的な感染が腸で起こる可能性が指摘されています(Natarajan et al, Med, 2022)。また、ウイルスが長期にわたって腸から検出された人の多くが、後遺症を発症したとする報告もあります(Zollner et al, Gastroenterology, 2022)。しかし、ヒトの腸におけるウイルス株間での感染動態がどのように変化しているのかについてはこれまで知見がありませんでした。
【研究概要】
ウイルスの増殖性と、細胞傷害性について
デルタ株、オミクロン株(BA.2、BA.2.75、BA.5、XBB.1)のウイルスをミニ腸に感染させ、ウイルスの増殖性を時間の経過にそって調べました。その結果、すべての株が腸への感染性を示しました(図1)。特に、デルタ株とオミクロン株BA.2.75では高い増殖性を示し、感染に伴って分泌される炎症性サイトカイン(IL-6、TNF-α)の量が高いことが分かりました。一方で、BA.2、BA.5、XBB.1では腸での増殖性が低く、これらの株を感染させたミニ腸からは、抗ウイルス活性を有するIFN-λ2が多く分泌されていました(図2)。
持続的な感染について
次に、感染の持続性について調べたところ、デルタ株やBA.2.75を感染させたミニ腸では、感染後30日が経ってもウイルスの増殖が続いていて、持続的な感染が強く示されました。これらの株を感染させたミニ腸へサイトカインの一種であるIFN-λ2を投与することによって、ウイルスの増殖を短期および長期にわたって抑制できるかどうかを検証した結果、IFN-λ2はデルタ株およびBA.2.75におけるウイルスの増殖を抑制させました(図3)。これは、腸のIFN-λ2がウイルスの増殖を抑制させる働きを持つ可能性を示唆しています。
【研究者コメント】
本研究では生体に近い立体臓器を用いることで、SARS-CoV-2の短期と長期の感染を多角的に捉えることに成功しました。SARS-CoV-2の持続的な感染はコロナ後遺症の要因の一つと考えられています。今後は、腸に潜伏するウイルスの排除に焦点を絞って、IFN-λ2のウイルス増殖を抑制させるメカニズムと、腸における免疫を活性化させる具体的な方法を提案することで、エビデンスベースドなコロナ後遺症予防法の確立を目指します。
また本研究では、ミニ腸が生体内におけるウイルス感染ダイナミクス、宿主応答を再現できる革新的なヒト腸管バイオモデルであるとともに、SARS-CoV-2の短期と長期という2つのフェーズの感染を観察することのできる有用なモデルであることが分かりました。
【発表論文情報】
タイトル: Replication efficiency of SARS-CoV-2 Omicron subvariants BA.2.75, BA.5, and XBB.1 in human mini-gut organoids.
著者: 宮川敬1,2*、町田正和3、川崎友之3、柿崎正敏4、木村弥生5、杉山真也6、長谷川秀樹1、梅澤明弘3、阿久津英憲3*、梁明秀2,4*
所属:
1)国立感染症研究所 インフルエンザ・呼吸器系ウイルス研究センター
2)横浜市立大学医学部微生物学
3)国立成育医療研究センター 再生医療研究センター
4)国立感染症研究所 ウイルス第三部
5)横浜市立大学 先端医科学研究センター
6)国立国際医療研究センター 感染病態研究部
掲載雑誌:Cellular and Molecular Gastroenterology and Hepatology
DOI:https://doi.org/10.1016/j.jcmgh.2024.03.003
参考論文
タイトル:Reduced Replication Efficacy of Severe Acute Respiratory Syndrome Coronavirus 2 Omicron Variant in "Mini-gut" Organoids
著者:Kei Miyakawa, Masakazu Machida, Tomoyuki Kawasaki, Mayuko Nishi, Hidenori Akutsu, Akihide Ryo
掲載雑誌:Gastroenterology
DOI:https://doi.org/10.1053/j.gastro.2022.04.043
【特記事項】
本研究は、日本医療研究開発機構 新興・再興感染症に対する革新的医薬品等開発推進研究事業「腸管オルガノイドを用いたCOVID-19罹患後症状に対する予防法開発」、日本学術振興会 科学研究費助成事業、武田科学振興財団研究助成金等の支援を受けて行われました。ミニ腸作製は、国立成育医療研究センター研究所と大日本印刷株式会社との共同研究の成果をもとに行われました。
【用語説明】
[1]オルガノイド:試験管の中で幹細胞から作られる、立体臓器。
[2]ミニ腸:ヒトiPS細胞より創り出した小腸の立体臓器モデルで、国立成育医療研究センターの阿久津
英憲らが2017年に開発。《参考》https://www.ncchd.go.jp/press/2017/es-organoid.html
[3]腸管上皮細胞:腸の組織を細菌から守るために粘膜バリアを構築する細胞で、栄養や水分の吸収
機能も担う。
[4]炎症性サイトカイン:炎症を促進させる重要な調節因子で、細胞から分泌されるタンパク質の総称。
[5]インターフェロン:サイトカインの1つで、抗ウイルス作用や、細胞の増殖を抑制させる作用など
がある。