�v���X�����[�X
���l�s����w
���\�̃|�C���g
��B�^�̉��E�C���X�͊̍זE���ɑ��݂���_�`�_�A����NTCP����e�̂Ƃ��ė��p���A�̍זE�Ɋ�������
�@���Ƃ��m���Ă��܂��B�{�����ł́AB�^�̉��E�C���X�̃G���x���[�v�^���p�N��LHBs��NTCP�̕���
�@�̂̃N���C�I�d�q�������\�����𖾂��܂����B
���\����́A�E�C���X���������A�_�`�_�A�������ɂ��ALHBs��N���[preS1�h���C����NTCP�̒_�`�_
�@�A���o�H���`�����閌�ђʃg���l�����ǂ��悤�ɕ��G�ɐ܂肽���܂�Č������邱�Ƃ𖾂炩�ɂ��A��
�@�̌������E�C���X�����ɏd�v�ł��邱�Ƃ����o���܂����B
��NTCP�����B�^�̉��E�C���X�̊����@�\�𖾂����B�^�̉��ɑ���V�K���Ö�̍����I�v�ɖ�
�@�Ɗ��҂���܂��B
[�摜1]https://user.pr-automation.jp/simg/1706/81746/350_215_2024011511515665a49dccd26e2.png
B�^�̉��E�C���X��������e��NTCP����Ċ̍זE�ɋz�����邵����
�T�v
�@������w��w�@��w�n�����Ȃ̐m�� ��w�@���i���������j�A�����q�V �����A��˔~�� �y�����A���l�s����w��w�@������Ȋw�����Ȃ̖p����i�p�N�W�F�q�����j�������A�Ζ{���̎m ��w�@���A�p�O�p�i�p�N�T�������j�����A���s��w��w�@��w�����Ȃ̖쑺�퐶 �������A��c�z �����A�쑺�I�� �y�����A���������nj��������Ö�E���N�`���J�������Z���^�[�̏��т��� �������i�������ȑ�w��w�@�n�旝�H�w������ ��w�@���j�A�n�m�K�� ���Ö�J��������������̋��������`�[���́AB�^�̉��E�C���X���������ɃE�C���X�^���p�N�����A�̍זE�\�ʂɑ��݂��銴����e�̂ł��閌�^���p�N��NTCP�Ɍ�������l�q���N���C�I�d�q���������͂ɂ��������܂����B
�@�{�������ʂ�2024�N1��17���t�i�p�����ԁF17���ߑO10���A���{���ԁF17��19���j��
Nature Structural & Molecular Biology �E�F�u�T�C�g�Ɍf�ڂ���܂����B
���\���e
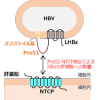
�@B�^�̉��E�C���X�iHBV�j�̊����́A���E�̖�2.9���l���ꂵ�߂��v�Ȍ��O�q�����ł��B����B�^�̉��i��1�j�͊̍d�ς�̍זE����������N�����A�N�Ԗ�80���l�����S���Ă��܂��B�������A����B�^�̉�������������ʓI�Ȏ��Ö@�͖����m������Ă��܂���BLHBs��HBV�̃E�C���X�\�ʂɔ������閌�^���p�N���ł���A����N���[�ɑ��݂���~���X�g�C����preS1�h���C�����̍זE�̊�ꖌ�ɔ������喬��������̍זE�ւ̒_�`�_�i��2�j�̎�荞�݂�S���A���̖��^���p�N��Sodium-taurocholate co-transporting polypeptide�iNTCP�j�ƒ��ڌ������邱�ƂŁAHBV�̊̍זE�ւ̋z������т��̌�̊������i�s����ƍl�����Ă��܂��i�}1�j�BPreS1����������NTCP�̗��̍\���͂���܂ʼn𖾂���Ă��炸�AHBV�ɂ��̍זE�F���@�\�Ɋւ���\���w�I�m���͕s�\���ł����B
[�摜2]https://user.pr-automation.jp/simg/1706/81746/350_358_2024011513151865a4b1567954a.png
�}1�FPreS-NTCP���������HBV�̊̍זE�ւ̋z��
�@�@�@�@�@�@
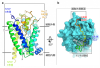
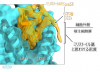
�@�{�����`�[���́A�|�{�זE�Ŕ��������q�gNTCP�ƃ~���X�g�C����preS1(2-48)�y�v�`�h���������ANTCP-preS1�����̂����邱�Ƃɐ������܂����B����ꂽNTCP-preS1�����̂ɂ��āA�\���F���R��Fab�i��3�j�Ƃ̕����̂����A������w�̃N���C�I�d�q�������i��4�jTitan Krios��p���ė��̍\�����𖾂��܂����B�\����͂̌��ʁANTCP��preS1��1:1�̔䗦�Ō������ApreS1����������NTCP�͌������Ă��Ȃ���ԂƗގ������O�J���\�����Ƃ��Ă��܂����i�}2�j�BNTCP�ւ�preS1�̌����͍L�͂ȑa�������ݍ�p����ѐ��f�����ɂ��`������Ă��܂����BPreS1(2-48)��N���[���̖�30�c���NTCP�̃g���l���̈�ɂ͂܂荞�ނ悤�ɁA���C���[���̖�20�c��͍זE�O���\�ʂ��悤�Ɍ������Ă��܂����BPreS1�͓���̗��̍\�����Ƃ��Ă��Ȃ��ƍl�����Ă��܂������ANTCP�g���l�������ŕ��G�ɐ܂肽���܂�Ă���A���m�̃E�C���X-��e�̌����Ƃ͈قȂ�U���K�����f���i��5�j�ɏ]���������l�����Ƃ邱�Ƃ����炩�ɂȂ�܂����B�܂��ApreS1��N���[�ɂ́A�~���X�g�C����Ǝv���閧�x��NTCP�̍č\�����ꂽ�E�ʊ����܃~�Z�����Ɋϑ�����܂����i�}3�j�B���̂��Ƃ���A�~���X�g�C����͏h��זE���Ɍq������邱�ƂŁApreS1�̌�����⋭���邱�Ƃ���������܂����B
[�摜3]https://user.pr-automation.jp/simg/1706/81746/350_239_2024011513151865a4b15670696.png
�}2�F�q�gNTCP-preS1�����̂̃N���C�I�d�q�������\��
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@
a. �N���C�I�d�q�������ɂ�茈�肳�ꂽNTCP-preS1�����̗̂��̍\���B���^���p�N���ł���NTCP�̍זE�O����preS1�y�v�`�h�i�I�����W�j
�@����������l�q���������ꂽ�BNTCP�͊O�J���\�����Ƃ��Ă����B
b. NTCP-preS1�����̗̂��̍\�����זE�O�����猩���}�BNTCP�͕\�ʐ}�ApreS1�̓J�[�g�D�[���}�iN���[�i�j-C���[�i�ԁj�j�ŕ\����
�@��Ă���BPreS1��N���[����NTCP�̃g���l���̈�Ǝ�v�Ȍ������`�����AC���[���͍זE�O���\�ʂ��悤�Ɍ������Ă����B
[�摜4]https://user.pr-automation.jp/simg/1706/81746/350_250_2024011513151865a4b15680c67.png
�@�}3�FPreS1��N���[�~���X�g�C����̖��x
�@PreS1��N���[�ɏC�����ꂽ�~���X�g�C����Ǝv���閧�x���ϑ����ꂽ�B���̖��x��NTCP�ߖT�̃~�Z�����Ɋϑ����ꂽ�B
�@
�@�\����͂���ђ_�`�_�A�������̌��ʁApreS1��NTCP�̒_�`�_�A���o�H���\������g���l���̈���L���邱�ƂŁA�_�`�_�̌�������їA���������I�ɑj�Q���邱�Ƃ����炩�ɂȂ�܂����i�}4�j�BNTCP��preS1�������ʂƒ_�`�_�������ʂ̑����͋��ʂ��Ă��܂������ANTCP�̍זE�O���\�ʂ̃��[�v�̈�▌�ђʃw���b�N�XTM8b�̈ꕔ��preS1�Ƃ̌����Ɋւ����̂́A�_�`�_�̗A���o�H�ɂ͏d�Ȃ�Ȃ����Ƃ���������܂����i�}5�j�B���������āA�����̗̈��W�I�Ƃ�����܂́ANTCP�̒_�`�_�A���@�\���ێ����Ȃ���ApreS1�̌����݂̂�}���ł���\��������A����̊J�������҂���܂��B
[�摜5]https://user.pr-automation.jp/simg/1706/81746/350_443_2024011513151865a4b1567dbcb.png
�}4�F�~���X�g�C����PreS1�ɂ���A���j�Q
�@�{�����œ���ꂽNTCP-preS1�����̂̍\���Ɗ����NTCP-�_�`�_�����̂̍\���iPDB:7ZYI�j�̏d�ˍ��킹�BPreS1��NTCP�̒_�`�_�A���o�H���\������g���l���̈���L���Ă����B
[�摜6]https://user.pr-automation.jp/simg/1706/81746/700_385_2024011513151865a4b156883ea.png
�}5�FPreS1�����j�Q��̕W�I��╔��
NTCP�ɑ���preS1�������ʁi���j�ƒ_�`�_�������ʁi�E�APDB:7ZYI�j�̔�r�B���҂̌������ʂ̓g���l���זE�O���Q�[�g�ŏd�Ȃ邪�A�זE�O���\�ʗ̈�▌�ђʃw���b�N�XTM8b�̈ꕔ��preS1�Ƃ̌����݂̂Ɋ֗^���邱�Ƃ��������ꂽ�BPreS1�����݂̂Ɋւ��̈�́A����p�̏��Ȃ��RHBV��̕W�I���Ƃ��ėL�]�ł���B
�@
�@�ȏ�̌��ʂ��AHBV���O�J���\�����Ƃ��Ă���NTCP��W�I�Ƃ��ApreS1���g���l���̈�Ƌ��łɌ��������邱�ƂŁA�E�C���X���q���̍זE���ɋߐڂ�����Ƃ������f�����l�����܂��i�}6�j�B
[�摜7]https://user.pr-automation.jp/simg/1706/81746/700_453_2024011513151865a4b1566d20d.png
�}6�FHBV�ɂ��h��זE�F�����f��
HBV�͊O�J���\�����Ƃ��Ă���NTCP��W�I�Ƃ��A�~���X�g�C����preS1���g���l���̈�Ƌ��łɌ��������邱�ƂŁA�E�C���X���q���h��זE���ɋߐڂ�����B���̍ہA�G���x���[�v�ɑ}������Ă���~���X�g�C����͏h��זE���ւƓ]�ڂ��ApreS1�̌�����⋭����ƍl������B
�@
�@�{�����̐��ʂ́AHBV���̍זE��F������X�e�b�v�̏ڍׂȍ\����Ղ������̂ł��B�܂��A���炩�ɂȂ���NTCP��preS1�̑��ݍ�p�l���͑��̃E�C���X�ł͕̂Ȃ��U���K�����f���ɏ]�����Ƃ���A�E�C���X�Əh��̑��l�ȑ��ݍ�p�l���̈�[�𖾂炩�ɂ�����̂ł��B����́A�זE�\�ʂɋz������HBV���ǂ̂悤�ȕ��q�@�\�ōזE���ɐN������̂��ɂ��āA�ڍׂɖ��炩�ɂ��邱�Ƃ����߂��܂��B
�@���ݗp�����Ă��鎡�Ö@�ł́A����B�^�̉��̊��҂Ɏ����������Ă���HBV��g�̂��犮�S�ɔr�����邱�Ƃ͓���A�V�K���J�j�Y���Ɋ�Â��RHBV��̊J�������߂��܂��BNTCP�ւ̌�����HBV���������ɕK�{�̃X�e�b�v�ł��邱�Ƃ���A���̃X�e�b�v��HBV������}�������Ŗ��͓I�ȑn��W�I���ƍl�����܂��B�{������HBV��preS1�Ɗ�����e��NTCP�̏ڍׂȑ��ݍ�p���������ꂽ���ƂŁApreS1�����j�Q��𗧑̍\���Ɋ�Â��č����I�ɐv���邱�Ƃ����҂���܂��B
�Z�֘A���F
�u�v���X�����[�X�@B�^�̉��E�C���X������e�̂ł���q�g���^���p�N���̍\�����𖾁v�i2022/5/18�j
https://www.u-tokyo.ac.jp/focus/ja/press/z0111_90020.html
���\�ҁE�����ғ����
������w��w�@��w�n������
�@��ˁ@�~���@�y����
�@�����@�q�V�@����
�@�@�m���@���������F���m�ے�
���s��w��w�@��w������
�@�쑺�@�I�ʁ@�y����
�@��c�@�z�@����
�@�쑺�@�퐶�@������
���l�s����w��w�@������Ȋw������
�@�p�@�O�p�i�p�N�@�T�������j�@����
�@�p�@����i�p�N�@�W�F�q�����j�@������
�@�Ζ{�@���̎m�@���m�ے�
���������nj���������E���N�`���J�������Z���^�[
�@�n�m�@�K��@����J������������
�@���с@�����@�������i�������ȑ�w��w�@�n�旝�H�w������ ��w�@���j
�_�����
�G�����FNature Structural & Molecular Biology
��@���FStructural basis of hepatitis B virus receptor binding
���Җ��FJinta Asami*, Jae-Hyun Park*, Yayoi Nomura*, Chisa Kobayashi*, Junki Mifune,
�@�@�@�@Naito Ishimoto, Tomoko Uemura, Kehong Liu, Yumi Sato, Zhang Zhikuan,
�@�@�@�@Masamichi Muramatsu, Takaji Wakita, David Drew, So Iwata, Toshiyuki Shimizu,
�@�@�@�@Koichi Watashi†, Sam-Yong Park†, Norimichi Nomura†, Umeharu Ohto†
�@�@�@�@(*�����M������, †�����ӔC����)
DOI: 10.1038/s41594-023-01191-5
URL: https://www.nature.com/articles/s41594-023-01191-5
��������
�{�����́A�����Ȋw�� �Ȋw������⏕��(�ۑ�ԍ�19H00976�A20H03499�A19H05779�A21H02449�A18K05334�A19H00923�A22H02556�A23H02724�j�AAMED �̉����������p���������Ɓi�ۑ�ԍ�JP22fk0310517�AJP23fk0310504�j�A�n��[�Z�p�x����Ճv���b�g�t�H�[���iBINDS�j�i�ۑ�ԍ�JP19am0101115�i�x���ԍ�1570�A1846�A1848�j�AJP21am0101079�j�Ȃǂ̊O�������x�����čs��ꂽ���̂ł��B
�p����
�i��1�j����B�^�̉�
B�^�̉��́AB�^�̉��E�C���X�����t��̉t������Ċ������ċN����̑��̕a�C�ł���B���̂����A6�J���ȏ㎝�����Ă���̑��̉��ǂ�����B�^�̉��ł���B����B�^�̉����҂̈ꕔ�͊̍d�ς�̍זE����ǂ���B
�i��2�j�_�`�_
�̑��ŃR���X�e���[�����琶���������X�e���C�h�������ŁA��������̎��b�̏����E�z���Ȃǎ�����ӂɏd�v�Ȗ������ʂ����Ă���B�܂œ��B�����_�`�_�̑����͒��ǂ�̑��ɔ�������_�`�_�g�����X�|�[�^�[�̍�p�ɂ��ċz������A���̏z���J��Ԃ��B
�i��3�jFab
�R�̂̏d����N���[�̈�ƌy������Ȃ�f�ЁB�^���p�N���̍\����͂ɂ����ẮA�W�I�^���p�N���̍\�����萫�̌�����͎��̖ڈ�ƂȂ邱�Ƃ�ړI�Ƃ��ė��p����邱�Ƃ�����B
�i��4�j�N���C�I�d�q������
�t�̒��f�ŗ�p���ꂽ���ቷ�������Ń^���p�N���Ȃǂ̐��̕��q�ɑ��ēd�q�����Ǝ˂��A�����̊ώ@���s�����߂̑��u�BX�������\����͖@��NMR�@�ɕ��ԃ^���p�N���̗��̍\����͎�@�̊�ՋZ�p�Ƃ��āA�ߔN�}���ȋZ�p�v�V�𐋂��Ă���B2017�N�ɂ́A���̊J���ɍv�����������ҎO���Ƀm�[�x�����w�܂����^����Ă���B
�i��5�j�U���K�����f��
�^���p�N���Ƃ��̃��K���h�I�ȑ��݂ƌ��Ȃ��A���҂����ݍ�p���Ȃ��痧�̍\����ω������A���e�a���̃^���p�N��–���K���h�����̂��`������Ƃ������f���B