プレスリリース
横浜市立大学大学院生命医科学研究科の大友秀明特任助教、山根努特任助教(現理化学研究所上級研究員)、小田隆研究員(現J-PARC研究員)、栗田順一特任助教、津中康央特任助教、池口満徳教授、西村善文特任教授は、金沢大学ナノ生命科学研究所の古寺哲幸教授との共同研究で、クロマチンの基本構造であるヌクレオソームの解離会合に関与するヒストンシャペロンとヒストンの動的な結合構造を統合的な相関構造解析法により初めて解明しました。今後、核内タンパク質の原子レベルでの機能解明による新たな治療薬の開発などへの応用が期待されます。
本研究は、『Journal of Molecular Biology』に掲載されました(2023年6月26日オンライン)。
研究成果のポイント
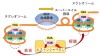
統合的な相関構造解析法として、核磁気共鳴(NMR*1)、X線小角散乱(SAXS*2)、多角度光散乱(MALS*3)、原子間力顕微鏡(AFM*4)、分子動力学(MD*5)計算と生化学実験を用いた
クロマチンの基本構造であるヌクレオソームの構築や解離に関与するヒストンシャペロン*6NAP1とヒストンH2A-H2Bの動的な複合体構造を解明
NAP1はワイヤ付きヘッドホン構造の凹部でヒストンH2A-H2Bと結合し、さらにもう一つのH2A-H2Bは2本のワイヤで動的に結合
動的に動くワイヤがヌクレオソーム中のH2A-H2Bの結合保持と介助に必要
[画像1]https://user.pr-automation.jp/simg/1706/73765/450_210_2023071215181764ae45a974765.jpg
図:NMR、SAXS、MALS、AFM、MD計算と生化学実験など複数の解析手法を 組み合わせた統合的相関構造解析法の概要図
研究背景
真核生物のDNAは様々な因子によって折りたたまれ、クロマチン構造と呼ばれる形をとっています。クロマチンは、ヒストンタンパク質にDNAが巻き付いたヌクレオソームという構造体がリンカーDNAで繋がれた繰り返し構造を基本とし(図1)、コアの構造はX線結晶構造解析やクライオ電子顕微鏡(Cryo-EM)によって決定されています。
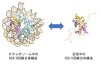
ヌクレオソームには4種類のヒストン(H2A、H2B、H3、H4)が2個ずつ含まれており、H3-H4の4量体構造を核としてH2A-H2Bの2量体構造が上下に重なり、約145塩基対のDNAが巻き付いています(図1,2)。
[画像2]https://user.pr-automation.jp/simg/1706/73765/300_168_2023071215183664ae45bc660c6.jpg
(図1)RNA合成酵素がDNA二重らせんをほどきヌクレオソーム中のH2A-H2Bが解離する模式図
[画像3]https://user.pr-automation.jp/simg/1706/73765/300_197_2023071215185364ae45cddf507.jpg
(図2)ヌクレオソーム中と解離した単離の時のH2A-H2Bの構造
ヌクレオソーム中のヒストンの構造に関してはX線やCryo-EMで多数報告されていますが、解離した単独のH2A-H2Bの構造は本研究グループによりNMRやMD計算で初めて報告しました(参考1)。ヒストンのH2AやH2BのN末やH2AのC末はふらふら揺らいでいて特定の構造を取っていませんが、H2A-H2Bのコアの構造はヌクレオソーム中とほとんど同じでした。さらにヌクレオソーム中でH2AとH2BのN末構造の揺らぎ方は単独の場合と異なっていて、お互いに2つのコンホメーションで揺らいでいる事も報告しています(参考2)。RNA合成やDNA合成の時にはDNAの二重らせんはほどかれて、ヌクレオソームからヒストンH2A-H2Bが解離し、また合成が終了した後のヌクレオソームではDNAは巻き戻されH2A-H2Bはヌクレオソーム中に再構成されます。ヒストンの解離会合にはヒストンシャペロンと呼ばれるタンパク質が関与します。シャペロンとは元々は社交界にデビューする少女の付き添い役の意味ですが、タンパク質が機能する時にその介添え役として使用され、ヒストンの補助タンパク質としてヒストンシャペロンが機能します。ヒストンシャペロンNAP1は当時の東京大学薬学部の石見らにより日本オリジナルのヌクレオソーム再構成に必要なタンパク質として1984年に同定され(参考3)、主にヒストンH2A-H2Bの核内輸送やヌクレオソームへの会合や解離に必要なタンパク質です。
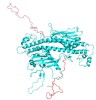
ヌクレオソームのX線結晶構造を初めて解析したLugerらにより酵母のNAP1のX線結晶構造解析が報告されNAP1は2量体を形成しヘッドホン型構造をしていました(参考4)。さらにヘッドホンから出たワイヤの様な紐様構造がNAP1のC末にありますが(CTAD)、結晶中では見えていません。ヘッドホン構造の凹部には負の電荷を帯びた溝を形成し、正電荷に富んだヒストンと結合していると考えられてきました。アミノ酸の配列からヘッドホン構造はヒトを含めてほとんど同じです。紐様構造のCTADは多様性があり、やはり負電荷を帯びたアミノ酸が多くヒストンと結合することが示唆されてきました(図3,4)。
[画像4]https://user.pr-automation.jp/simg/1706/73765/300_312_2023071215185964ae45d386da7.jpg
(図3)計算で得られたヒトNAP1の2量体構造。ヘッドホン型構造の上から見た図で上下に紐様のCTADが動的に揺らいでいる。
[画像5]https://user.pr-automation.jp/simg/1706/73765/400_92_2023071215190764ae45db56db6.jpg
(図4)ヒトNAP1の2量体が突き出たCTADがH2A-H2Bと相互作用する模式図(参考5)。1個目のH2A-H2BはCTADに結合したのちにNAP1の溝に動的に取り込まれ2個目のH2A-H2BはCTADに結合する。
[画像6]https://user.pr-automation.jp/simg/1706/73765/200_145_2023071215192264ae45ea34390.jpg
[画像7]https://user.pr-automation.jp/simg/1706/73765/200_148_2023071215192764ae45ef30552.jpg
(図5)NAP1のCTADにH2A-H2Bが結合した構造。(左)NMRで求めたCTAD単独とH2A-H2Bの複合体構造をNAP1の全体構造に当てはめた構造の1例。(右)NAP1の溝にH2A-H2Bが結合した構造の1例。SAXSの実験からはNAP1にH2A-H2Bが1個結合したときには左の構造が約8%で右の構造が約92%の割合で動的に存在することが分かった。
本研究グループは既にヒトNAP1のCTADがヒストンH2A-H2Bと非常に強く結合し、CTADが無いとヌクレオソームの再構成が出来なくなることを報告しています(参考5)。またヒトNAP1にH2A-H2Bが結合するとCTAD領域とNAP1の凹部の領域の間で動的に結合している事も報告しています。これまでにNAP1とH2A-H2Bの複合体構造がX線結晶構造解析で報告されてきましたが、多様な静的な結合様式が報告され実際の溶液中での動的な結合様式は全く不明でした。
研究内容
本研究では溶液中の多様な動的な結合様式を解明するために、核磁気共鳴(NMR)、X線小角散乱(SAXS)、多角度光散乱(MALS)、原子間力顕微鏡(AFM)、分子動力学(MD)計算と生化学実験を用いました。
NMRは分子量が大きいタンパク質の構造を解析する事は困難なので、先ず単離したCTADとH2A-H2Bの複合体構造をNMRで求めました。溶液中のH2A-H2Bの2量体の全体構造は既に本研究グループで解析していました(参考1)。CTADの中の2つの部位がH2A-H2Bの塩基性領域と疎水性領域に結合していることが分かりNMR構造を求める事が出来ました。さらにNAP1全体をNMRで測定するとCTAD領域はふらふらしていて、単離したCTADと同じようにシグナルを観察できH2A-H2Bを加えると単離したCTADと同じようにCTAD部位のシグナルが変化しました。NAP1に1個のH2A-H2Bが結合した時のMALSとSAXSの実験から、NAP1のCTADに結合した構造とNAP1の溝に結合した構造の動的な分布があり約8%がCTAD結合型で約92%が溝結合型でした(図5)。
次にH2A-H2Bが2個結合した状態のMALS/SAXSの実験から1個のH2A-H2BはCTAD結合型でもう1個は溝結合型でした(図6)。
[画像8]https://user.pr-automation.jp/simg/1706/73765/300_241_2023071215193764ae45f99a07a.jpg
(図6)NAP1に2個のH2A-H2Bが結合した構造の1例。1個のH2A-H2BはCTAD結合型でもう1個は溝結合型であった。
これらの構造は当研究室で以前提案したモデルを支持する構造でした。
NAP1とH2A-H2Bの複合体の構造解析が今まで非常に困難だった理由の一つはNAP1のCTADがふらふら揺らいでいてCTADの構造的な役割が不明であったことと、同じ溝結合型でも動的に揺らいでいて結晶構造解析で静的な描像を得にくいことでした。またNAP1は2量体が安定な基本構造ですが、さらにNAP1は以下のAFM像で示すように多量体構造をとります。よって溶液中でNAP1の構造を解析する時には常に様々な多量体構造が生じ、均一な系での構造解析が困難になります。H2A-H2Bを加えるとAFM像で示すようにNAP1は2量体に解離し、2個のH2A-H2BとのCTAD結合型の像が得られました。溝結合型が全く見えない理由はAFMでNAP1を観察する時にNAP1の溝の部位が顕微鏡に用いる基板表面に結合して覆われているためであると考えられます。またNAP1が多量体を形成する理由は、NAP1が細胞質で存在する時に多量体のプール(貯蔵庫)を形成し、細胞質で新生されたH2A-H2BにNAP1を迅速に供給するためだと考えられます。H2A-H2Bと結合する時は、NAP1は2量体になり、核に移行しヌクレオソームの構築に関与します。単独のNAP1が多量体を形成しやすいことは、均一な系での構造解析では大きな妨害になります。ヌクレオソームへのH2A-H2Bの結合や解離の機能にはNAP1の2量体で十分です。よって多量体形成をしないNAP1変異体を作成しAFMで安定な2量体を確認しました(図7)。
本研究では均一な系での溶液構造解析を行うために、H2A-H2B結合の機能は保持したNAP1変異体を用いています。さらにゲルろ過(size exclusion chromatography:SEC)を用いてタンパク質の会合体が均一な条件でSAXSやMALSの実験行っています。
[画像9]https://user.pr-automation.jp/simg/1706/73765/500_169_2023071215194564ae460158caa.jpg
(図7)NAP1の原子間力顕微鏡(AFM)像。(左)NAP1だけのAFM像では棒状の多量体が形成されていた。(中)NAP1にH2A-H2Bが結合すると棒状構造が壊れ、NAP1の2量体にH2A-H2Bが結合したAFM像が得られる。(右)AFM像のモデル。
本研究の結果を基にNAP1がヌクレオソームからH2A-H2Bを解離する機構は模式的に図8のように考える事ができます。NAP1のCTADがヌクレオソーム中のH2A-H2Bと結合する場合は、ヌクレオソーム中の末端の約30塩基対程度のDNAが、例えばRNA合成酵素による超らせんストレスに等によりはがされ、NAP1のCTADがDNAの代わりにヌクレオソーム中のH2A-H2Bと結合します。その後、H2A-H2BがNAP1の溝に結合するとともにH2A-H2Bはヌクレオソームからはがされます(図8)。再結合の時には例えばRNA合成酵素の通過後にできたヌクレオソームに巻き付くためのDNAの超らせんのストレスが逆にNAP1のCTADからH2A-H2Bを引きはがします。NAP1中でH2A-H2Bが溝結合型とCTAD結合型の間で動的に揺らいでいる事がヌクレオソームからのH2A-H2Bの解離や再結合をスムーズに起こすために必要だと考えられます。
今後の展開
現在巨大タンパク質の機能を原子レベルで解析し、タンパク質の機能解明さらにはタンパク質機能不全から生じる疾病の治療候補化合物のデザイン等の研究が精力的に行われています。特にタンパク質を結晶化したX線結晶構造解析やタンパク質を氷中で固定化したCryo-EMによる解析が精力的に行われ、多数の構造が報告されています。これらの構造解析により巨大タンパク質中のコアの構造が精密に解析され巨大タンパク質の構造変化が細かなブロックの積み重なりの変化として解析できるようになりました。しかしタンパク質の機能にはふらふらと揺らいでいる紐様の構造(天然変性状態)が重要な役割を持つ場合があります。特に核内で機能するタンパク質では天然変性状態が約50%もある場合があり、ここで取り上げたクロマチンの構成タンパク質であるヒストンやヒストンシャペロンでは揺らいでいる領域が非常に重要な機能を持っています。それらの構造を解析するために本研究で示したようなNMR、SAXS、MALS、AFM、MD計算など統合的な相関構造解析が必要です。今後核内タンパク質の原子レベルでの機能解明のために本研究で提案した相関構
造解析がますます重要になると思われます。
[画像10]https://user.pr-automation.jp/simg/1706/73765/500_324_2023071215195164ae460760a75.jpg
(図8)NAP1がヌクレオソームからH2AH2Bを乖離させるときの模式図。先ずNAP1のCTADがヌクレオソーム中のH2AH2Bにアクセスする。CTADはH2BのN末テイルとH2AのC末テイルと相互作用し、H2AH2Bのヌクレオソーム中での安定化を弱めてCTADの結合を強め次にH2AH2Bがヌクレオソームから解離すると同時にNAP1の溝のH2AH2Bを納める。
研究費
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」、文部科学省「先端研究基盤共用促進事業(共用プラットフォーム形成支援プログラム) NMR共用プラットフォーム」、日本学術振興会科学研究費(基盤研究B)の一環で行われました。
論文情報
Dynamic solution structures of whole human NAP1 dimer bound to one and two histone H2A-H2B heterodimers obtained by integrative methods.
Hideaki Ohtomo, Tsutomu Yamane, Takashi Oda, Noriyuki Kodera, Jun-ichi Kurita, Yasuo Tsunaka, Romain Amyot, Mitsunori Ikeguchi, and Yoshifumi Nishimura
DOI:https://doi.org/10.1016/j.jmb.2023.168189
用語説明
*1 NMR:
強い磁場中で特定の原子核スピンの向きが揃えられた化合物やタンパク質などに対し、ラジオ波を照射して核磁気共鳴させた後、核スピンが元の安定な状態に戻る際に出す信号を観測して、原子の配置などを解析する装置。分子量が30KDaを超えるような大きなタンパク質では、水溶液中のタンパク質の動きが遅くなりNMRの観測は困難になるが、巨大タンパク質中でもふらふらと揺らいでいるN末やC末の部位は小分子の動きと同じく速いので原子レベルでの同定が可能である。
*2 X線小角散乱(SAXS):
タンパク質水溶液などの試料にX線を照射し、得られる散乱X線の角度分布から試料分子の形状を解析する方法。NMRのような分子量の制限がなく、X線結晶構造解析のように目的タンパク質を結晶化する必要がない反面、分解能が低い欠点があるため、NMRやMDなど原子分解能での情報と合わせることで有効な解析が可能。
*3多角度光散乱(MALS):
タンパク質水溶液などの試料に光を照射し、得られる散乱光の角度分布から試料分子の分子量を決定する方法。
*4原子間力顕微鏡(AFM):
原子間力顕微鏡は、レコードプレーヤーの針がレコード盤の表面の形状をなぞるように、探針(プローブ)と試料間の相互作用を2次元に走査し、試料の起伏の画像を取得する顕微鏡。生体分子が機能する水溶液中であっても、分子の形状をナノメートルの空間分解能で観察することができる特徴を持つ。
*5分子動力学(MD)計算:
計算機シミュレーションの手法の一つ。計算機上に水分子やイオンなども含めた系を構築してタンパク質分子の生体内部における様子を模倣し、その全原子間に働く相互作用を考慮してニュートンの運動方程式を数値的に解くことをくりかえすことにより、生物の体温程度でのナノ秒〜ミリ秒の時間スケールの生体内での蛋白質などの分子の挙動をシミュレーションする。本研究で用いたhNAP1とH2A-H2Bの複合体のMDシミュレーションでは、約100万原子程度の大きさの系について、100ナノ秒(0.1ミリ秒)の計算を行っている。
*6ヒストンシャペロン:
ヒストン分子に結合しヌクレオソームへヒストンを運搬し再構成する時の介助タンパク質。DNA合成やRNA合成の時にはDNA二重らせんはほどかれてヌクレオソームからヒストンが解離し、さらに合成終了時にはヒストンは再結合しヌクレオソームが再構成される時に、ヒストンシャペロンは介助役を果たす。ヒストンシャペロンとしてはここで取り上げたNAP1以外にもFACTがあり、FACTのサブユニットSpt16タンパク質のC末天然変性領域とヌクレオソーム中でのヒストンH3のN末の天然変性領域との相関構造やH2A-H2Bの相関構造に関してはやはり当研究室でNMR法等を用いて既に報告した(6−9)。
参考文献
1. Y. Moriwaki, T. Yamane, H. Ohtomo, M. Ikeguchi, J. Kurita, M. Sato, A. Nagadoi, H. Shimojo, Y. Nishimura, Solution structure of the isolated histone H2A-H2B heterodimer., Sci. Rep. 6 (2016) 24999. https://doi.org/10.1038/srep24999
2. H. Ohtomo, J. Kurita, S. Sakuraba, Z. Li, Y. Arimura, M. Wakamori, Y. Tsunaka, T. Umehara, H. Kurumizaka, H. Kono, Y. Nishimura, The N-terminal Tails of Histones H2A and H2B Adopt Two Distinct Conformations in the Nucleosome with Contact and Reduced Contact to DNA, J. Mol. Biol. 433 (2021) 167110. https://doi.org/10.1016/j.jmb.2021.167110
3. Y. Ishimi, J. Hirosumi, W. Sato, K. Sugasawa, S. Yokota, F. Hanaoka, M. Yamada, Purification and initial characterization of a protein which facilitates assembly of nucleosome-like structure from mammalian cells., Eur. J. Biochem. 142 (1984) 431–9. https://doi.org/10.1111/j.1432-1033.1984.tb08305.x
4. Y.J. Park, K. Luger, The structure of nucleosome assembly protein 1, Proc. Natl. Acad. Sci. U. S. A. 103 (2006) 1248–1253. https://doi.org/10.1073/pnas.0508002103
5. H. Ohtomo, S. Akashi, Y. Moriwaki, M. Okuwaki, A. Osakabe, K. Nagata, H. Kurumizaka, Y. Nishimura, C-terminal acidic domain of histone chaperone human NAP1 is an efficient binding assistant for histone H2A-H2B, but not H3-H4, Genes to Cells. 21 (2016) 252–263. https://doi.org/10.1111/gtc.12339
6. Tsunaka Y, Ohtomo H, Morikawa K,Nishimura Y. Partial Replacement of Nucleosomal DNA with Human FACT Induces Dynamic Exposure and Acetylation of Histone H3 N-Terminal Tails. iScience. 23, 101641 (2020). https://doi.org/10.1016/j.isci.2020.101641
7. Tsunaka Y, Ohtomo H,Nishimura Y. FACT modulates the conformations of histone H2A and H2B N-terminal tails within nucleosomes.Commun Biol. 5, 814. (2022). https://doi.org/10.1038/s42003-022-03785-z
.
8. Tsunaka Y, Furukawa A,Nishimura Y. Histone tail network and modulation in a nucleosome. Curr Opin Struct Biol. 75, 102436. (2022).
https://doi.org/10.1016/j.sbi.2022.102436
.
9. Okuda M, Tsunaka Y,Nishimura Y. Dynamic structures of intrinsically disordered proteins related to the general transcription factor TFIIH, nucleosomes, and histone chaperones. Biophysical Reviews 14, (2022). https://doi.org/10.1007/s12551-022-01014-9
[画像11]https://user.pr-automation.jp/simg/1706/73765/500_107_2023071215454964ae4c1d5d1d7.png