プレスリリース
藤田医科大学医療科学部レギュラトリーサイエンス分野 毛利彰宏教授、長谷川眞也大学院生、國澤和生准教授、鍋島俊隆客員教授、齋藤邦明学部長らは、精神・神経病態解明センター 神経行動薬理学研究部門 永井拓教授との共同研究により、うつ病に関与する新たな病態メカニズムの解明を行いました。これまでの研究で、必須アミノ酸のトリプトファンを起点としたトリプトファン-キヌレニン経路の変容がうつ病に関与することは示唆されていました。しかし、ストレスがこの経路をどのように変容させるか、その変容がうつ病に関与するのかは未解明でした。 本研究では慢性ストレス負荷によりうつ病モデルマウスを作製し、行動学的・神経科学的解析を行いました。その結果、うつ病に深く関与する脳領域である海馬※1において、慢性ストレスはトリプトファン-キヌレニン経路内の代謝物であるキヌレン酸を増加させました。このキヌレン酸は、α7ニコチン性アセチルコリン受容※2に結合し、社会機能や意欲の低下などの抑うつ様行動を引き起こしていることがわかりました。また、慢性ストレスによるキヌレン酸の増加にはキヌレニン-3-モノオキシゲナーゼ(KMO)※3を発現するミクログリア※4の減少が関与していることを発見しました。さらに、このミクログリアの減少にはストレスホルモンであるコルチコステロンの長期的な曝露が寄与していることがわかりました。 これらの研究結果は、日々の慢性的なストレスが脳内でキヌレン酸を増加させ、それがうつ病病態を形成していることを示唆しています。そのため、α7ニコチン性アセチルコリン受容体※2は新たな抗うつ薬の標的となることが期待されます。
本研究成果は、学術ジャーナル「British Journal of Pharmacology」のオンライン版で2024年12月10日に公開されました。
論文URL :https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bph.17407
研究成果のポイント
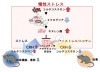
慢性ストレスによる抑うつ様行動には脳内の海馬※1におけるキヌレン酸の増加を介したα7ニコチン性アセチルコリン受容体拮抗作用が関与することを証明
慢性ストレスによるキヌレン酸の増加には、コルチコステロンの長期曝露を介したミクログリア※4の減少が関与していることを発見
α7ニコチン性アセチルコリン受容体※2は新たな抗うつ薬の標的となる可能性を示唆
背景
現在の抗うつ薬はモノアミン仮説※5に基づいて開発されています。しかし、うつ病患者の約40%は治療抵抗性を示すため、うつ病に関連する新たな病態メカニズムの解明およびそのメカニズムに基づいた新たな抗うつ薬の開発が求められています。うつ病の発症メカニズムの一つとして、ストレスや炎症が重要な役割を果たすと考えられています。また、トリプトファン-キヌレニン経路の変動がうつ病などの精神神経疾患と強く関与することがこれまでの研究で示唆されていますが、ストレスがこの経路をどのように変容させるか、その変容がうつ病に関与するのかは未解明でした。本研究では、慢性ストレス負荷によるうつ病モデルマウスを用いて、トリプトファン-キヌレニン経路の関与について検討しました。
研究手法・研究成果
慢性予測不能軽度ストレスによるうつ病モデルマウス(CUMSマウス)を作成しました。このCUMSマウスでは、社会性や意欲の低下を示すうつ様行動が観察されました。また、トリプトファン-キヌレニン経路に関わる代謝物を高速液体クロマトグラフィーを用いて測定したところ、海馬※1という脳領域でキヌレン酸が増加していました。さらに、その経路に関わる代謝酵素の遺伝子発現変化をリアルタイムPCR(qPCR)を用いて測定した結果、経路内の代謝酵素の一つであるキヌレニン-3-モノオキシゲナーゼ(KMO)※3の減少が認められました。免疫染色により、この酵素が脳内の免疫細胞であるミクログリア※4に発現していることが確認され、KMOとミクログリアの発現量の減少も認められました。加えて、血液中でストレスホルモンであるコルチコステロン濃度の上昇がELISA法により明らかとなったため、野生型マウスにコルチコステロンを長期間投与したところ、社会機能と意欲の低下、そしてKMOやミクログリアの発現量の低下が認められました。また、CUMSマウスにニコチンを投与すると、社会機能と意欲の低下が改善されましたが、その改善効果はメチルリカコニチン(α7ニコチン性アセチルコリン受容体拮抗薬)により打ち消されました。さらに、ニコチンはストレスホルモンであるコルチコステロンの産生に関与するコルチコトロピン放出ホルモン(CRH)の増加も抑制しました。
今後の展開
これらの研究成果は、新たなうつ病の病態メカニズムとして、日々の慢性的なストレス曝露は脳内でキヌレン酸を増加させ、それがうつ病病態を形成している可能性を提唱しました。今後、この病態メカニズムに基づいたα7ニコチン性アセチルコリン受容体※2を標的とした新たな抗うつ薬の開発が期待されます。
[画像1]https://digitalpr.jp/simg/2299/100922/650_467_20241212142524675a73c479bf3.jpg
用語解説
※1 海馬
海馬は記憶をつかさどる脳部位です。海馬の機能低下はうつ病との関連も示唆されています。
※2 α7ニコチン性アセチルコリン受容体
神経伝達物質であるアセチルコリンおよびニコチンを結合する受容体です。ニコチン性アセチルコリン受容体には、α(α1〜α10), β(β1〜β4), δ, γ, εの17種類のサブユニットが存在し、それらの組み合わせにより受容体が構成されており、それぞれ様々な役割を持ちます。
※3 キヌレニン-3-モノオキシゲナーゼ(KMO)
トリプトファン-キヌレニン経路内における主要な代謝酵素の一つ。
※4 ミクログリア
脳内の免疫細胞と言われています。形態を柔軟に変化させることができ、脳内環境の恒常性を維持するために監視する役割を担っています。
※5 モノアミン仮説
モノアミンとは、ドーパミン、ノルアドレナリン、セロトニンなどの神経伝達物質の総称です。モノアミン仮説とは、モノアミンの欠乏がうつ病を引き起こしているという仮説のことを指します。現在ではモノアミンの欠乏を改善させる薬が抗うつ薬として使用されています。
[文献情報]
論文タイトル
Chronic stress induces behavioral changes through increased kynurenic acid by downregulation of kynurenine-3-monooxygenase with microglial decline
著 者
長谷川眞也1、國澤和生1,5、ウラルボラテ2,3、窪田悠力1,5、倉橋仁美1、坂田昂駿1、
安藤穂乃実2、藤垣朱和子2、藤垣英嗣2、山本康子2、永井拓5、齋藤邦明2,3,4、鍋島俊隆3,4,5、
毛利彰宏1,4,5
所 属
1 藤田医科大学 医療科学部 レギュラトリーサイエンス分野
2 藤田医科大学 医療科学部 先進診断システム開発分野
3 藤田医科大学 医療科学部 健康医科学創造共同研究部門
4 NPO医薬品適正使用推進機構
5 藤田医科大学 精神・神経病態解明センター
掲載誌
British Journal of Pharmacology
掲載日
2024年12月10日発行
DOI
10.1111/bph.17407
本件に関するお問合わせ先
学校法人 藤田学園 広報部 TEL:0562-93-2492 e-mail:koho-pr@fujita-hu.ac.jp