プレスリリース
【研究成果のポイント】
◆ ナノポア※1の片側に有機溶媒を混ぜてDNAの1分子検出を実施。
◆ ナノポア付近の非対称な液体誘電率分布によってDNAのイオン電流※2信号が数十倍増強されることを発見。
◆ 今後の固体ナノポアシークェンサー開発におけるブレークスルーになると期待。
● 概要
大阪大学 産業科学研究所の筒井真楠准教授・川合知二招へい教授、産業技術総合研究所の横田研究員、華中科技大のYuhui He教授による国際共同研究グループは、ナノポアセンサによる1分子DNA検出において、1分子当たりのイオン電流信号強度を数十倍増強させる新たな手法を開発することに成功しました。
これまでのナノポアセンサでは、均質な生理食塩水中でナノポアを通るイオン電流を測定し、DNAがナノポア内のイオン輸送をブロックする際に生じるイオン電流変化を観測することで、DNAの1分子検出を行っていました。しかし、DNAは直径が僅か2ナノメートルの紐状分子であることから、イオンの流れをあまり効果的にブロックしません。加えて、DNAはその周りに高密度なカチオン(正のイオン)を引き連れているため、DNAがナノポアを通る際にはナノポア内のイオン濃度が増大します。つまり、イオンの通り道がDNAの大きさ分だけ狭められる一方で、より多くのイオンがナノポア内に供給される、というわけです。
この相反する二つの効果のため、DNA通過時に現れるイオン電流信号は非常に小さなものとなり、1分子検出や塩基配列の解読が困難でした。
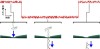
そこで当共同研究グループでは、生理食塩水の誘電率を変えることで、DNAの周囲に集まるカチオンの効果を制御しました。その結果、ナノポアの片側にエタノールやグリセロールを加えるだけで(図1)、DNAのイオン電流信号を数十倍にまで増強できることを明らかにしました。本成果により、ナノポアセンサの1分子感度が飛躍的に向上し、固体ナノポア1分子シークェンサーを大きく実現に近づけることが期待されます。
本研究成果は、Wileyが発刊する「Small Methods」に、10月6日(木)(日本時間)に公開されました。
画像1: https://www.atpress.ne.jp/releases/328979/LL_img_328979_1.jpg
図1. ナノポアの上下に2種類の異なる液体を導入して実施するDNAの1分子検出の様子を表した模式図。
● 研究の背景
ナノポアは、固体や生体の膜に空けられたナノメートルスケールの細孔です。ナノポアセンサでは、この小さな細孔を生理食塩水で満たし、2個の電極を用いて電圧を加えることでNa+やCl-といったイオンがナノポアを流れるようにします。すると、電極間にはナノポア内におけるイオンの流れやすさに応じたイオン電流が生じます(図2左)。この電流を測定している際に、微小な物体がナノポアに入ってくると、その物体によってナノポア内のイオンの流れが妨げられ、イオン電流は小さくなります(図2中央)。そして物体がナノポアを通過しきった後は、またナノポアはイオンが流れやすい状態に戻り、イオン電流も再び元の値に戻ります(図2右)。
ここで、大きな物体ほどより顕著にイオンの流れをブロックしますので、それだけ大きなイオン電流変化が現れます。この原理により、ナノポアを通過する物体の数をカウントしながら、それぞれの物体の体積を測定することが可能になります。これはコールター原理として古くから知られ、白血球や赤血球などの血球をカウントする手法として、現在血液検査で広く実用されているものです。
画像2: https://www.atpress.ne.jp/releases/328979/LL_img_328979_2.jpg
図2. ナノポアを用いたDNAの1分子検出。DNAが通過する前、ナノポアはイオンが流れやすい状態にあるため、高いイオン電流が測定される(左)。DNAがナノポアを通過する際は、その分子の体積分だけ空間が排斥されるため、イオンが流れにくい状態になり、イオン電流は減少する(中央)。その後、DNAがナノポアを通過しきると、ナノポアはまたイオンの流れやすい状態になり、イオン電流も元の値に戻る(右)。
一方、ナノポアでDNAを検出する場合には少し事情が異なってきます。まずDNAは直径が僅か2ナノメートルの極めて細い紐状の構造を持つため、ナノポアを通る時にイオンの流れをあまりブロックしません。これに加えて、水中ではDNAのリン酸基が負の電荷を持つため、その周囲には正のイオン(カチオン)が集まります。つまり、DNAはその周りに高濃度なカチオンを引き連れてナノポアに入ってくるわけです。これにより、DNAが通過する過程では、分子の体積分だけ空間を排斥することでナノポア内のイオン濃度が減少する一方で、分子周囲に集まっている高密度なカチオンのせいでナノポア内のイオン濃度は増大することになります。この相反する効果によって、DNAのイオン電流信号は非常に微弱なものになることが知られていました。
そこで当共同研究グループでは、有機溶媒を混ぜて生理食塩水の誘電率を変化させると、DNAのイオン電流信号がどう変わるかを調べました。液体の誘電率を低くすると、DNAの周囲に集まるカチオンの量が少なくなると理論的に予測できます。そこで、ナノポアの片側には従来どおり食塩水を加え、反対側には食塩水とエタノールの混合液を加えました(水とエタノールの比誘電率はそれぞれ80と24)。すると、DNAがナノポアを食塩水から混合液に向かう方向に通過させた場合には、ナノポア間の液体誘電率の差に応じて、イオン電流信号がより顕著に増強されることを発見しました(図3右)。
また逆に、混合液から食塩水に向かう方向で通過させた場合は、イオン電流信号が同じく増強され、かつ信号の極性まで変化することを明らかにしました(図3左)。均質な食塩水を用いる従来の手法と比較すると(図3中央)、1.3倍の液体誘電率の差を用いて数十倍のイオン電流信号増強が達成できました。
画像3: https://www.atpress.ne.jp/releases/328979/LL_img_328979_3.jpg
図3. 有機溶媒によるイオン電流信号増強。従来の方法では均質な食塩水中でDNA検出を行う。この場合、DNAの周囲に集まるカチオンの効果もあり、非常に微弱なイオン電流信号が観測される。それに対し、エタノールやグリセロールといった水よりも低誘電率な有機溶媒をナノポアの下側に混合すると、DNA周囲のカチオンの効果が抑制され、DNA通過時に現れるイオン電流信号が増強される(右)。また、同じ有機溶媒をナノポアの上側に加える場合は、カチオン効果が増大する結果、信号が増強されるだけでなく、その極性も反転する(左)。増強の度合いはナノポア上下の液体誘電率の差に比例し、1.3倍の誘電率差を付与した場合は、DNAのイオン電流信号が数十倍増強できる。
また、同様の信号増強効果はグリセロール(比誘電率は47)を混合した場合でも確認されました。この場合は、グリセロールの高い粘性のため、食塩水と混ぜた時に誘電率だけでなく粘性も大きく変化したことから、結果としてイオン電流信号が増強されると同時に、DNAがナノポアを通過する速度を減速できる(図4)ことを明らかにしました。
画像4: https://www.atpress.ne.jp/releases/328979/LL_img_328979_4.jpg
図4. グリセロールを用いたDNAの1分子検出。エタノールの場合と同様、液体誘電率の効果により、グリセロールの混合率に比例してイオン電流信号の増強が可能。加えて、グリセロールの高い粘性により、DNAのナノポア通過速度も低速化することができる。
● 本研究成果が社会に与える影響(本研究成果の意義)
生体ナノポアを用いた1分子シークェンシングは、ハイスループットなゲノム解析法として近年世界中で利用されるようになってきています。この原理を固体デバイスに置き換えることで、さらにより安価で高速な1分子シークェンサーが実現できると考えられています。しかし、固体ナノポアによるDNA塩基配列解読では、その微弱な信号強度に加えて、DNAがナノポアを高速に通過することが重要な課題とされてきました。今回、グリセロールをナノポアの片側に混ぜるという汎用的な手法によって、DNAの大幅な信号増強とナノポア通過速度の低速化が同時に達成できたことは、今後の固体ナノポアによるDNAシークェンサーを実現に大きく近づけるブレークスルーになると期待されます。
● 特記事項
研究成果は、2022年10月6日(木)(日本時間)に「Small Methods」のオンライン版で公開されました。
タイトル:“Ionic signal amplification of DNA in a nanopore”
著者名 :Makusu Tsutsui, Kazumichi Yokota, Yuhui He, Tomoji Kawai
DOI :10.1002/smtd.202200761
● 用語説明
※1 ナノポア
ナノメートル(10億分の1メートル)スケールの細孔。
※2 イオン電流
電荷を持った原子・原子団(イオン)の運動によって生じる電流。本研究では、ナノポアを挟んで電圧を印加することで、イオンをナノポアに強制的に通過させる。物体がポアを通過する際、ポア内のイオンはその物体の体積によって排除されるので、瞬間的にイオンの流れが阻害され、電気的なシグナルとして検出できる。
● 筒井准教授URL (研究者総覧)
https://rd.iai.osaka-u.ac.jp/ja/350a1072cefba177.html
● これまでの研究成果
AI技術とナノポアセンサで1個のインフルエンザウイルスの高精度識別に成功!
https://resou.osaka-u.ac.jp/ja/research/2018/20181121_1
ナノポアセンサ×ペプチド工学でインフルエンザウイルスを1個レベルで認識する新規ナノバイオデバイスの開発に成功!
https://resou.osaka-u.ac.jp/ja/research/2019/20190110_3
AI技術とナノポアセンサでウイルスの複数種識別に成功!
一回の検査で複数のウイルス、感染症の原因特定に期待
https://resou.osaka-u.ac.jp/ja/research/2020/20201110_2
水の力でもっと精密にナノ粒子をとらえる!
ナノポアデバイスの開発で高精度な解析の実現へ
https://resou.osaka-u.ac.jp/ja/research/2021/20210316_2
注目のナノポアセンサ AIでノイズを制御し精密に形状を測定!
https://resou.osaka-u.ac.jp/ja/research/2021/20210514_1
DNA検出可能なナノポアセンサを開発!
超高感度変異ウイルス検査システムへの応用に期待
https://resou.osaka-u.ac.jp/ja/research/2021/20210824_2
イオンを流すとナノポアが加熱!
ウイルスの検出と無害化を同時に行えるナノポアセンサ開発へ
https://resou.osaka-u.ac.jp/ja/research/2022/20220212_1
プレスリリース提供元:@Press