プレスリリース
藤田医科大学 医学部 微生物学講座 河合 聡人 講師、土井 洋平 教授、米国MDアンダーソンがんセンター William C. Shropshire 博士、Samuel A. Shelburne教授らの国際共同研究グループは、多剤耐性グラム陰性細菌による感染症治療に用いられるセフタジジム(第3世代セファロスポリン)–アビバクタム(β-ラクタマーゼ阻害剤)合剤で治療中の患者から、この合剤に高度耐性を示す大腸菌を単離し、その原因がCMY-2 β-ラクタマーゼの4アミノ酸変異体 CMY-185であることを突き止めていました。そして、今回、このCMY-185がアビバクタムの結合を拒絶しながら、セフタジジムの分解活性を保持する巧みな酵素の分子メカニズムを原子レベルで解明しました。
本研究成果は、1月5日に米国微生物学会が出版している学術ジャーナル「mBio」のオンラインへ掲載されました。
論文URL : https://doi.org/10.1128/mbio.02874-23
研究成果のポイント
セフタジジム–アビバクタム合剤で治療中の患者から単離された大腸菌が有したβ-ラクタマーゼCMY-2の4アミノ酸変異体(A114E、Q120K、V211S、N346Y)であるCMY-185の薬剤耐性メカニズムを研究。
X線結晶構造解析、分子動力学計算、酵素速度論解析により、CMY-185が有するN346Y変異がセフタジジムとアビバクタムを識別するセンサーとして働き、残り3つの変異が協調してセフタジジムの分解能を有したままアビバクタムの結合を拒否する分子メカニズムを原子レベルで解明。
背景
抗菌薬が効かない薬剤耐性病原性細菌の蔓延は世界的な問題で、WHO(世界保健機関)も公衆衛生上最大の脅威の1つとして対策を講じています。抗菌薬は感染症治療の切り札ですが、これらを多用することで強い抗菌薬にも抵抗性を持つ細菌だけが生き残ってしまい、その細菌が増殖して世の中がどの抗菌薬も効かない薬剤耐性細菌だらけになることが危惧されています。そこで、世界的に「抗菌薬の適正使用」が優先課題となり、今日の細菌感染症治療では、原因となっている細菌を特定し、その細菌に適切な抗菌薬を最適な量と日数で治療を行うことが今まで以上に求められています。
研究グループは、米国MDアンダーソンがんセンターに入院していた術後感染症治療中の患者で、起因菌を調べ、その段階で適切な抗菌薬を選択し治療したにも関わらず、すぐに薬剤耐性の大腸菌が出現し、再度最適な抗菌薬の選択と変更を行ってもその薬が効かない大腸菌が次々と採取された症例を報告しました(Shropshire WC et al., High-level ceftazidime/avibactam resistance inEscherichia coliconferred by the novel plasmid-mediated β-lactamase CMY-185 variant. J Antimicrob Chemother. 78(10):2442–2450. 2023 doi: 10.1093/jac/dkad249)。この報告では、薬剤耐性傾向が特に強いグラム陰性細菌による感染症治療に使用されるセフタジジム–アビバクタム合剤にも耐性を示した大腸菌のゲノム解析により、CMY-185と命名された新たなβ-ラクタマーゼを産生していることがわかりました。CMY-185は、これまでに報告のあったβ-ラクタマーゼCMY-2のアミノ酸配列と比較して4カ所のアミノ酸変異(A114E、Q120K、V211S、N346Y)を有する酵素です。そして、N346Y変異を主軸に他の変異が重なることでセフタジジム–アビバクタム合剤への耐性度が高くなっていくことを実験的に確かめました。しかし、これらの変異がセフタジジム–アビバクタム合剤への耐性にどのように関与しているのかについては謎のままでした。
研究手法・研究成果
研究グループはまずCMY-185の有する各変異が「セフタジジムの分解」と「アビバクタムによる阻害の回避」のどちらに寄与するのかを調べるため、変異の組み合わせが異なる7種類の酵素を調製して(変異無し:CMY-2、1変異体:V211S、N346Y、2変異体:A114E_N346Y、Q120K_N346Y、V211S_N346Y、4変異体:CMY-185)、実際に薬が分解される速度や阻害の強度を調査しました。その結果、V211S変異はセフタジジム分解効率を向上させることがわかりました。加えて、N346Y変異が導入された酵素はアビバクタム阻害活性が1/1,000に弱まり、N346Y変異にA114E変異やQ120K変異が加わるとそれぞれ阻害活性が1/2,000、1/10,000とさらに減弱されることがわかりました。また、アビバクタム阻害活性の減弱は、アビバクタムが酵素へ結合しにくくなったことが要因であることも突き止めました。
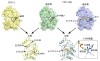
次に、視覚的にCMY-185がセフタジジムを分解する様子を観察するため、CMY-185の結晶を調製し、茨城県つくば市にある高エネルギー加速器研究機構の放射光実験施設Photon Factory BL-17Aビームラインを利用してX線結晶構造解析法による立体構造の決定を行いました(図1)。その結果、CMY-185の立体構造はCMY-2の立体構造と全体的にはよく似ているものの(図1左下)、N346Y変異の導入によって、薬が結合する部位が局所的に狭くなっていることがわかりました(図1中上)。しかし、ここにセフタジジムが結合すると、変異したY346残基側鎖の回転が生じると共に、H-10ヘリックスと呼ばれる部位の構造崩壊が起こり(図1右下)、CMY-2より薬の結合する部位が広がっている様子が観察されました(図1右上)。過去に報告されたβ-ラクタマーゼとセフタジジム及びアビバクタムの結合様式に関する研究結果も踏まえて考察すると、アビバクタムは、酵素のN346残基を含む周辺のアミノ酸によって、アビバクタム分子の硫酸基側が重点的に認識されます。そのため、CMY-185のようにN346Y変異が導入されると、この重点的な認識機構が崩れたことが致命傷となってアビバクタムが結合できなくなっていることが想定されました。一方で、セフタジジムは、酵素が分子全体を認識して結合させているため、結合の邪魔になるN346Y変異が導入されたとしても他のアミノ酸との相互作用の方が勝り、Y346残基の方が回転によってセフタジジムとの衝突を回避し、その結果H-10ヘリックス構造の崩壊が起こり、より薬が結合する部位が広がったものと推測されました。
さらに実験的に決定したCMY-185とセフタジジム複合体の立体構造を初期モデルとして、分子動力学シミュレーションによって分子の動きを観察したところ、残り3つの変異(A114E、Q120K、V211S)の導入によって、CMY-2では存在しない分子内相互作用が安定的に形成されることが示唆されました。そして、A114E変異は分子内部の相互作用が増強し酵素の剛体化が進むことで全般的な酵素活性が減弱し、Q120K変異は従来アビバクタムの認識に関与していたQ120残基の変異による相互作用喪失に加えて、アミノ酸自体が基質結合部位の方へ向かない形で固定されることで、よりアビバクタムが結合できないようになっていることが示唆されました。また、V211S変異の導入によって、分解された後のセフタジジム分子の動きが激しくなっている様子が観察され、これによって酵素から分解されたセフタジジムが離脱しやすくなり、次から次へとセフタジジム分解酵素反応のサイクルが回るようになったことが想定されました。
[画像1]https://user.pr-automation.jp/simg/2299/81521/600_364_20240110103234659df3b29f129.jpg
図1 CMY-185とCMY-2、セフタジジム結合前後の立体構造比較
今後の展開
本研究を通して、CMY-185は酵素とそれぞれの薬の結合様式の違いを、Y346残基の回転に反映させる分子メカニズムによって、セフタジジム、アビバクタムそれぞれの分子を識別していることが明らかになりました。また、このY346残基のセンサーは、セフタジジム分解を亢進させる変異(CMY-185ではV211S)、または、アビバクタム阻害を減弱させる変異(CMY-185ではA114EとQ120K)と合わさることで、実臨床で問題となる薬剤耐性細菌の出現へとつながります。本研究結果は、今後、N346Y変異型β-ラクタマーゼを有する病原性細菌の出現と同時に、酵素に導入されている他の変異もモニタリングする重要性を提示するとともに、これらを指標にβ-ラクタ厶系薬の耐性傾向予測につながることが期待されます。また、本研究結果はアビバクタムと同様のdiazabicyclooctane 系 β-ラクタマーゼ阻害薬は、分子全体を酵素で認識されるような分子設計にすると今回のN346Y型β-ラクタマーゼに有効になることが示唆されます。
本研究はJSPS科研費23K06267、公益財団法人 武田科学振興財団、米国NIAIDグラントR21AI151362の助成を受けて実施しました。また、放射光X線回折実験は高エネルギー加速器研究機構放射光科学研究施設共同利用実験(2017G554、2019G592)として、Photon Factory BL-1AおよびBL-17Aにて行いました。
文献情報
●論文タイトル
Structural insights into the molecular mechanism of high-level ceftazidime–avibactam resistance conferred by CMY-185
●著者
河合聡人1,2(責任著者), William C. Shropshire3, 鈴木匡弘1,2, Jovan Borjan4, Samuel L. Aitken4, William C. Bachman5, Christi L. McElheny5, Micah M. Bhatti6, Ryan K. Shields5, Samuel A. Shelburne3, 土井洋平1,2,5,7(責任著者)
●所属
1. 藤田医科大学 医学部 微生物学講座
2. 藤田医科大学 感染症研究センター
3.Department of Infectious Diseases, Infection Control, and Employee Health, The University of Texas MD Anderson Cancer Center
4. Division of Pharmacy, The University of Texas MD Anderson Cancer Center
5. Division of Infectious Diseases, University of Pittsburgh School of Medicine
6. Department of Laboratory Medicine, Division of Pathology/Lab Medicine, The University of Texas MD Anderson Cancer Center
7. 藤田医科大学 医学部 感染症科
●DOI
10.1128/mbio.02874-23
本件に関するお問合わせ先
学校法人 藤田学園 広報部 TEL:0562-93-2868 e-mail:koho-pr@fujita-hu.ac.jp